01
官方突袭飞检 公布结果
3月3日,国家药监局发布《医疗器械飞行检查情况通告(2022年第1号)》(以下简称《通告》)。
《通告》显示,核查中心于2021年10月至12月组织开展了医疗器械生产企业飞行检查工作,发现北8家企业存在一般项目不符合《医疗器械生产质量管理规范》及相关附录要求。
针对检查中发现的不符合要求问题,核查中心请相关省、自治区、直辖市药品监督管理局督促企业按要求限期整改,要求企业评估产品安全风险,对存在安全风险的,应按照《医疗器械召回管理办法》召回相关产品。
企业完成整改后,相关省级药品监督管理局应及时组织对整改情况进行确认,并将确认结果报送国家药品监督管理局食品药品审核查验中心。
02
8家械企共69条缺陷
《通告》显示,上海震海医用设备有限公司、常州瑞捷生物科技有限公司、欧普康视科技股份有限公司、南昌市福康医疗器械有限公司、山东威高普瑞医药包装有限公司、深圳市顺美医疗股份有限公司、四川国纳科技有限公司,这8家企业存在一般项目不符合《医疗器械生产质量管理规范》及相关附录要求。
其中,一次性使用手术衣、一次性使用无菌导尿管、超声手术刀系统、角膜塑形用硬性透气接触镜、一次性使用无菌阴道扩张器、一次性使用无菌注射针球囊扩张导管、非顺应性冠状动脉球囊扩张导管、一次性使用无菌中心静脉导管及附件医用纳米羟基磷灰石/聚酰胺66复合骨充填材料被检查不合格。
具体检查情况如下图:

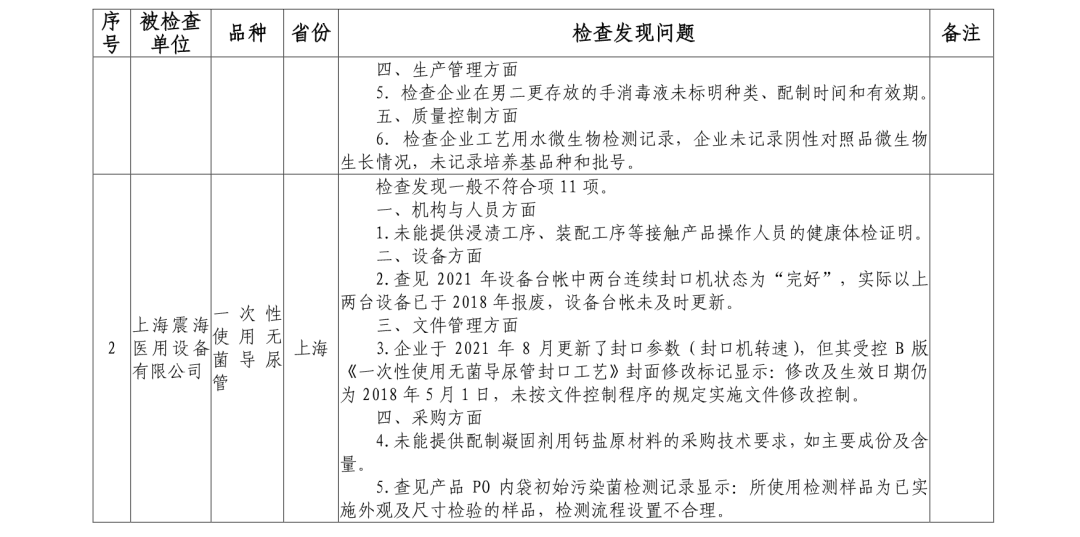









其中,欧普康视的角膜塑形用硬性透气接触镜检查发现一般不符合项6项。
03
全国各地积极开展飞检,集采中标企业成重点
随着《医疗器械监督管理条例》的落地,医疗器械生产企业的合规性迎来强监管时代。
今年年初,全国医疗器械监督管理工作会议中就明确表示,2022年要加大对疫情防控医疗器械抽检力度。抽检不合格的企业将会面临整改、停产,甚至高额罚款。
2月22日,国家药品监督管理局也公布了今年的国家医疗器械抽检产品检验方案,共有60种医疗器械参与抽检。
除常规飞检外,针对集采中标企业的飞行检查,近年来也成为了重点。
去年9月,国家药监局综合司特别下发了关于《加强集中带量采购中选医疗器械质量监管工作方案》的通知(以下简称“方案”)。
“方案”要求,各省级药品监管部门立即组织对本辖区内人工关节国家集中带量采购中选企业开展专项检查,对中选品种开展专项抽检,将中选企业纳入重点监管。
全国政协委员马进,在去年召开的两会上还提出,“在常规集采飞检的基础上,针对中标后中选产品的生产线发生剥离或变更的企业,应建立独立的重点监管名单。”
他发现,集采产品使用与医院学科品牌建设存在一定冲突,部分中标企业可能存在供应短缺等问题。
针对集采后环节,飞行检查或需还能发挥更大的作用。
本文著作权属原创者所有,不代表本站立场。我们转载此文出于传播更多资讯之目的,如涉著作权事宜请联系删除。
0