医疗器械包装货架有效期一旦超过,就意味着该器械产品在使用中具有潜在风险,可能不再满足性能指标和发挥预期用途。因此,医疗器械货架有效期非常重要,近年来无菌医疗器械包装广泛使用,但是,用了无菌医疗器械包装就可以保证无菌医疗器械在使用前一直处于安全无菌的状态吗?
其实不然,医疗器械包装所使用材料的物理性能以及粘贴剂可能会随着时间的推移而发生降解,从而导致其在贮存和运输过程中发生动态事件,这一系列问题最终会破坏包装系统的完整性,导致系统内的医疗器械产品受到污染。
来看看相关的政策要求
2021年国家药品监督管理局医疗器械技术审评中心发布了《无源植入性医疗器械货架有效期注册申报资料指导原则 (2021年修订版)》(征求意见稿)意见的通知,指导原则中明确指出无源非植入性医疗器械有关货架有效期注册申报时的相关测试要求。
该指导原则第三部分“货架有效期验证”内容中提到,医疗器械货架有效期的验证试验通常可包括加速稳定性试验、实时稳定性试验等。鉴于医疗器械产品更新换代速度较快,采用加速稳定性试验可加快产品的上市需求。加速稳定性试验设计是建立在假设材料变质所涉及的化学反应遵循阿列纽斯(Arrhenius)反应速率函数基础上的,具体可参考标准YY/T 0681.1和ASTM F1980。而有些医疗器械不适用于采用加速稳定性验证的,需要进行实时稳定性验证。
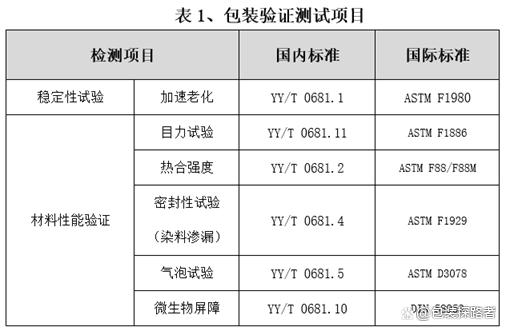
无论加速稳定性试验还是实时稳定性试验,针对于产品自身及包装系统均要进行相应的测试项目。测试项目是评估产品随时间老化的相关性能,就包装系统性能测试而言,可采用包装完整性测试,包括包装封口完整性、包装强度和微生物屏障性能等测试项目。
其中,包装完整性测试项目包括染色液穿透法测定透气包装的密封泄漏试验、目力测试和气泡法测定软性包装泄漏试验等;包装强度测试项目包括软性屏障材料密封强度试验、无约束包装抗内压破坏试验和模拟运输试验等。另外,指导原则建议注册申请人在试验过程中设立多个测试观察时间点(一般不少于3个)测试。
因此,中心实验室推荐企业在做医疗器械包装验证时,相关检测项目可参考以下表格。
总之,无菌医疗器械包装是保障无菌医疗器械产品安全有效的重要组成部分。通过上述物理检测以及最终包装件的模拟运输试验,以保证医疗器械产品的安全性和有效性。
医疗器械货架有效期是以医疗器械以终产品形式储存,能够发挥拟定作用的时间段。医疗器械包装货架有效期的终点是产品失效日期,超过此期限后,就意味着该器械可能不再满足已知的性能指标,不能发挥预期功能。因此,为更好地保障医疗器械的合规性,本文参照最新政策,整理了医疗器械货架有效期验证的要点,供大家参考。