深圳国际医疗器械展览会在深圳会展中心(福华三路)隆重举行,内容全面涵盖了包括医用电子、医学影像设备、病房护理及辅助设备、医用敷料、体外诊断试剂、光学、急救、康复护理以及医疗信息技术等产品,直接并全面服务于医疗器械行业从源头到终端整条医疗产业链,将来自20多个国家的1000多家医疗器械生产企业和超过40000人次的医院买家和经销商、代理商汇聚 “2021第三十三届深圳国际医疗仪器设备展览会”交易、交流。
来源: 江苏省药监局作者:2021年07月23日 10:44
为加强医疗器械全生命周期管理,依法推进实施江苏省医疗器械唯一标识系统,提升医疗器械质量监管和卫生管理效能,切实保障公众用械安全,根据国家药品监督管理局、国家卫生健康委员会、国家医疗保障局《关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告》(2020年第106号)有关部署要求,特制定《江苏省推进医疗器械唯一标识工作实施方案》
江苏省药品监督管理局 江苏省卫生健康委员会江苏省医疗保障局关于印发江苏省推进医疗器械唯一标识工作实施方案的通知
各设区市市场监督管理局、卫生健康委员会、医疗保障局,省药品监督管理局各检查分局,各相关单位:
为加强医疗器械全生命周期管理,依法推进实施江苏省医疗器械唯一标识系统,提升医疗器械质量监管和卫生管理效能,切实保障公众用械安全,根据国家药品监督管理局、国家卫生健康委员会、国家医疗保障局《关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告》(2020年第106号)有关部署要求,特制定《江苏省推进医疗器械唯一标识工作实施方案》,现印发给你们,请严格遵照执行。
江苏省药品监督管理局
江苏省卫生健康委员会
江苏省医疗保障局
2021年7月15日
江苏省推进医疗器械唯一标识工作实施方案
为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)精神,推进实施新修订的《医疗器械监督管理条例》,根据国家药品监督管理局、国家卫生健康委员会、国家医疗保障局《关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告》(2020年第106号)(以下简称《公告》)要求,结合我省实际,制定本工作方案。
一、指导思想
深入贯彻党中央、国务院关于实施健康中国战略和深化医药卫生体制改革的决策部署,落实“四个最严”要求,加强对医疗器械全生命周期监管,建立医疗器械唯一标识系统,实现医疗器械唯一标识在产品全生命周期各环节快速、准确识别,促进医疗器械注册、生产、经营、使用等各环节的精准化管理,形成从源头注册生产到最终临床使用全链条联动,推进医药、医疗、医保的全域应用,提高监管效能和社会治理能力,切实保障公众用械安全。
二、工作目标
(一)贯彻实施《公告》,指导和督促相关单位实现医疗器械唯一标识的创建及赋予、数据的上传下载和共享功能。
(二)开展唯一标识在医疗器械生产、经营和使用等各环节的应用,探索唯一标识在医疗器械不良事件报告、产品召回等环节的应用。
(三)结合医药、医疗、医保“三医联动”,探索医疗器械唯一标识在卫生、医保等领域的衔接应用,实现注册审批、产品生产、临床应用、医保结算等信息平台的数据共享。
三、实施范围
(一)实施品种
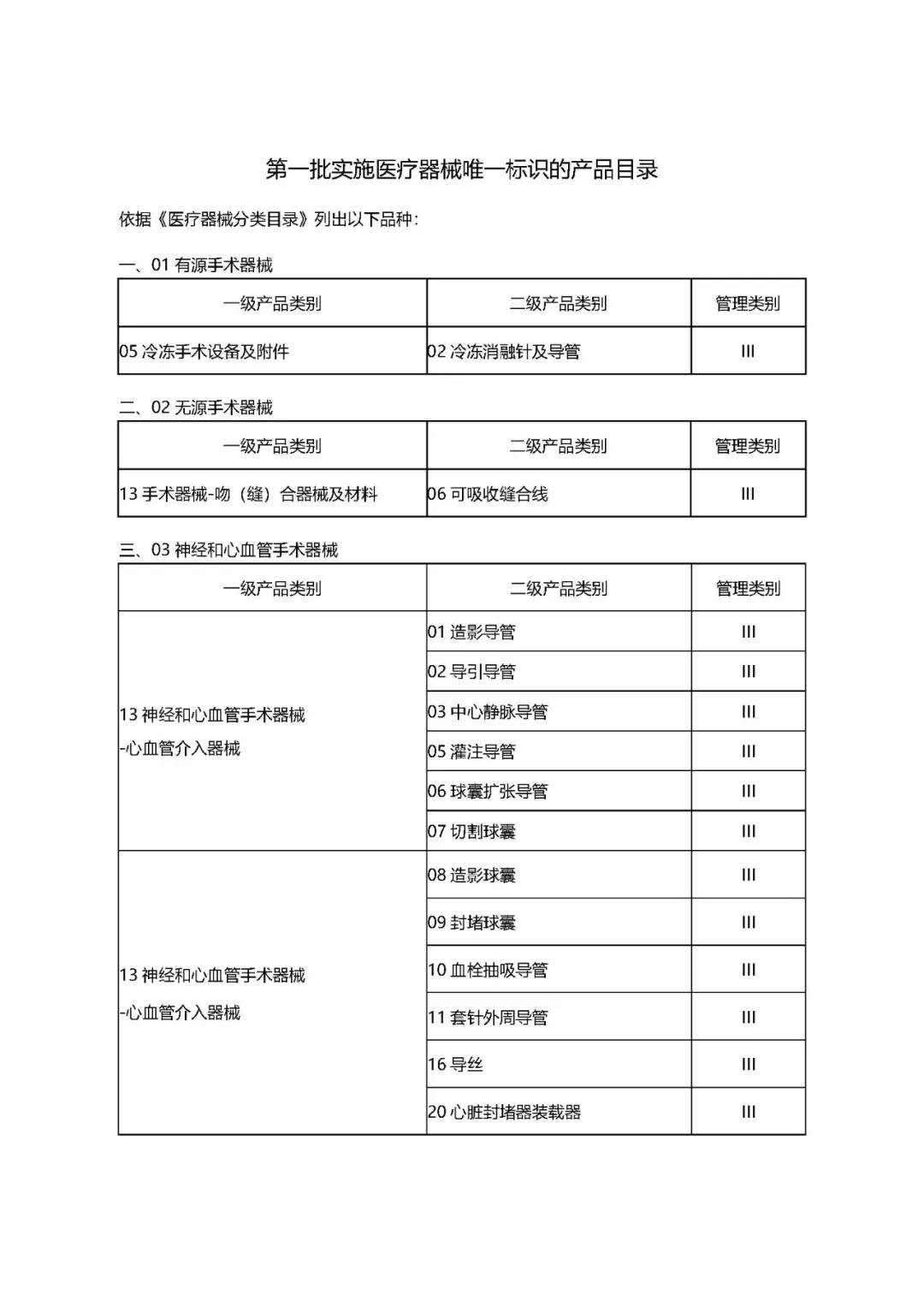
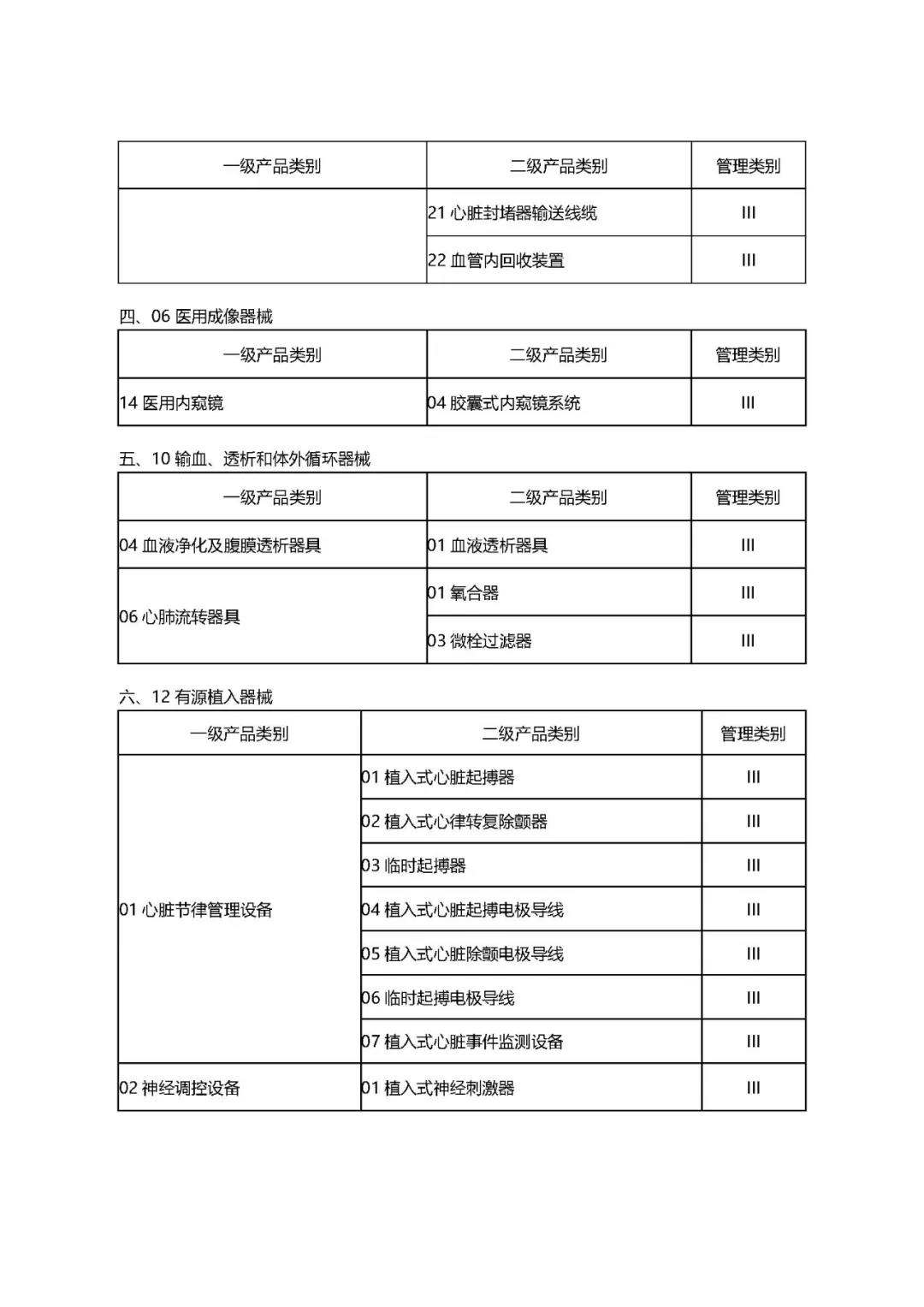
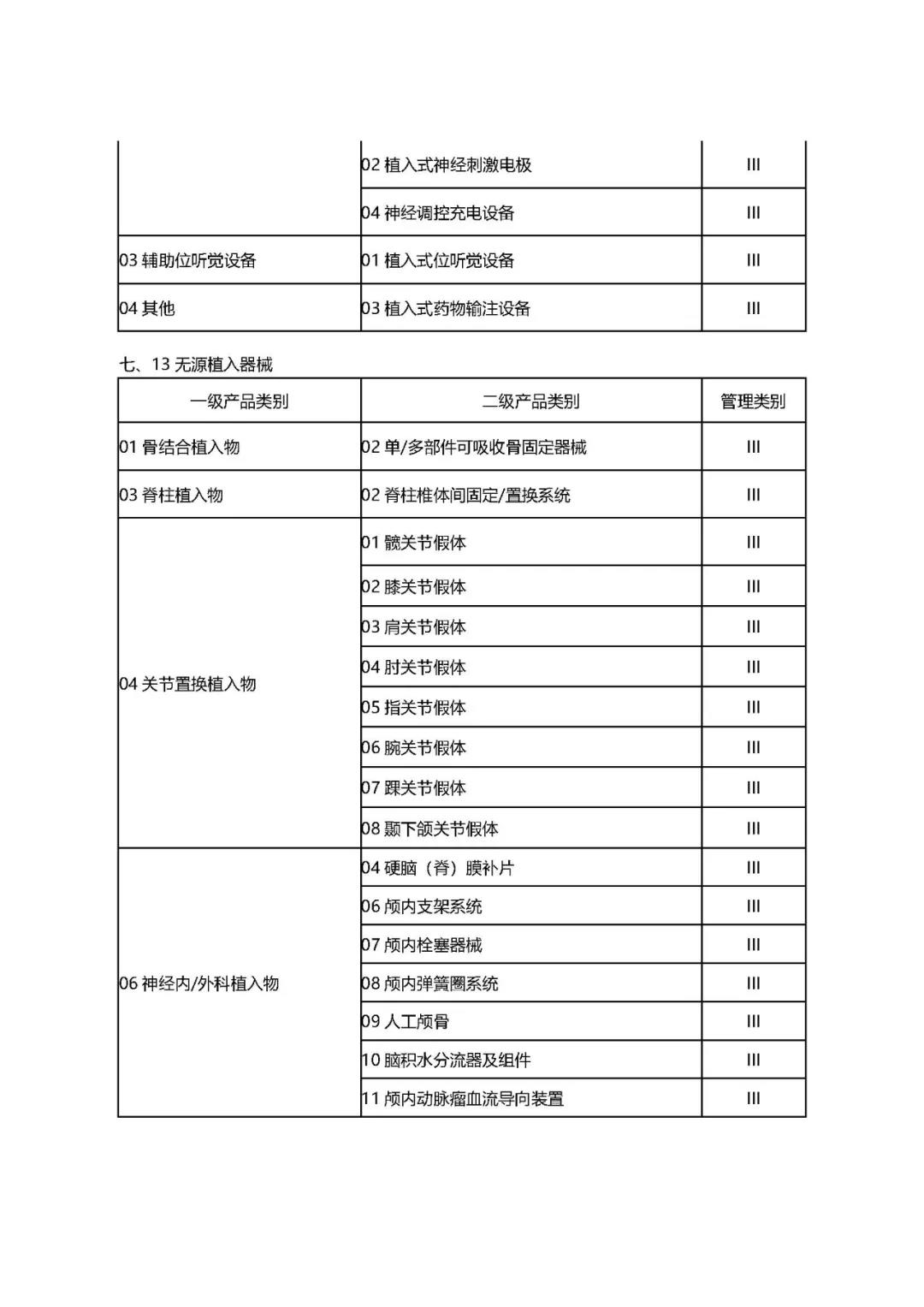
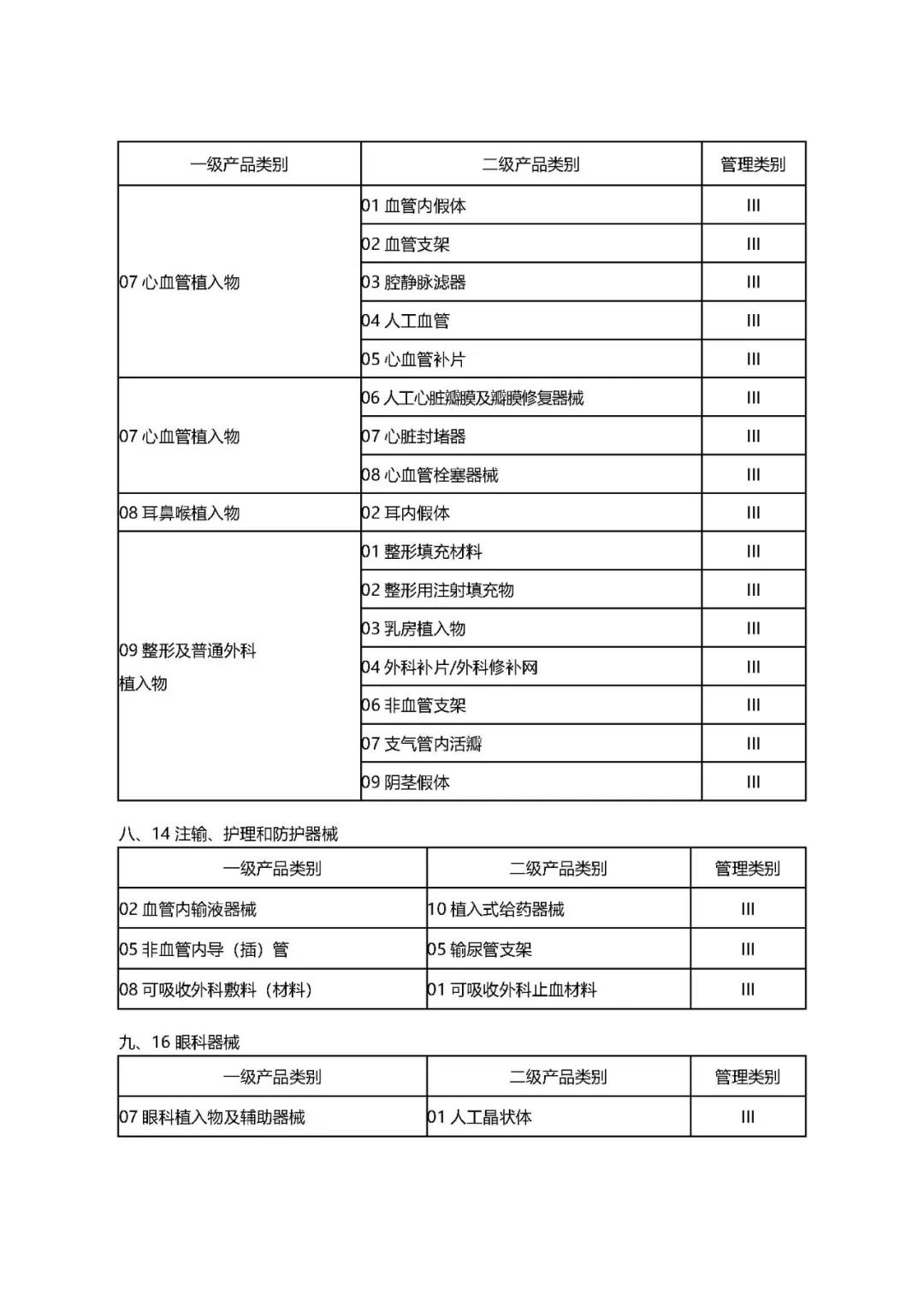
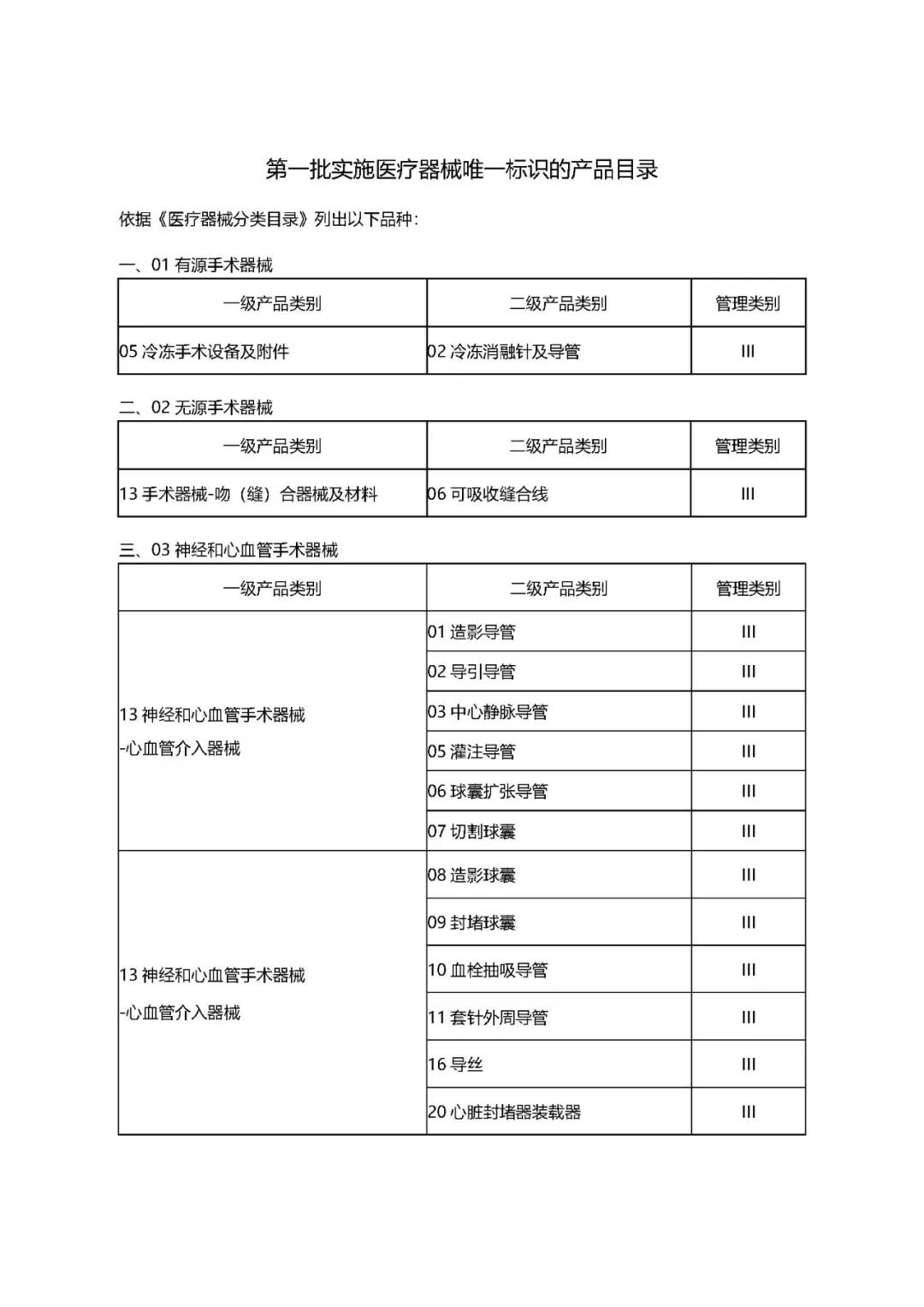
1.《公告》中确定的9大类69个高风险第三类医疗器械品种;
2.鼓励《公告》以外的其余第三类医疗器械(含体外诊断试剂)实施唯一标识;
3.鼓励《第一批国家高值医用耗材重点治理清单》中的其他品种实施唯一标识;
4.鼓励在我省注册、生产的第二类医疗器械逐步实施唯一标识。
(二)实施单位
1.拟申报实施品种的注册申请人或持有实施品种注册证的注册人;
2.医疗器械经营企业;
3.医疗机构。
四、工作任务
(一)医疗器械注册人
负责制定本单位唯一标识工作实施方案,确立实施品种,按照国家药品监督管理局《医疗器械唯一标识系统规则》(2019年第66号公告),对其产品创建并赋予唯一标识;可在国家药品监督管理局网站(国家药品监督管理局医疗器械唯一标识数据库https://udi.nmpa.gov.cn/)中选择发码机构。负责向国家药品监督管理局唯一标识数据库上传相关数据,向下游企业或者使用单位提供唯一标识信息,并对数据的真实性、准确性、完整性负责。与经营企业或使用单位积极交流,探索建立在产品追溯中唯一标识的应用模式,及时评估实施效果,形成相应操作规范。
(二)医疗器械经营企业
负责制定本单位唯一标识工作实施方案,探索建立医疗器械经营业务中应用唯一标识的工作流程,以及唯一标识数据库数据与医疗器械经营质量管理信息系统的对接操作流程,验证多码并行的操作性。参与高值医用耗材集中带量采购的医疗器械经营企业、为其他生产经营企业提供配送服务的医疗器械经营企业负责医疗器械唯一标识的扫码使用管理,实现对所有已赋码的产品进行扫码入库、出库,并做好与上下游单位数据衔接工作。鼓励其它医疗器械经营企业尽快参与实施唯一标识系统的运行。同时,探索与医疗器械注册人、使用单位、监管部门的协同机制,及时反馈对接应用过程中存在的问题。
(三)医疗机构
已开展唯一标识试点的医疗机构,应实现对所有已赋码产品的唯一码应用,积极推进唯一标识的医疗器械在院内全程扫码流转,推动运用唯一标识实现对医疗器械的精细化管理。鼓励其他医疗机构逐步推进唯一标识运用工作,探索运用唯一标识实现对医疗器械的精细化管理。
医疗机构应按照实施品种的范围,做好唯一标识与医疗业务系统的对接工作,探索唯一标识与医疗器械管理、临床应用等系统的衔接。
(四)药品监督管理部门
省药品监督管理局统筹指导唯一标识实施工作,协调相关单位研究解决唯一标识实施过程中出现的问题,做好与国家药品监督管理局的工作衔接,探索唯一标识在医疗器械全生命周期监管和追溯等工作中的应用。
省药品监督管理局及检查分局指导督促省内相关医疗器械注册人做好唯一标识数据上传、维护和更新等工作,探索唯一标识在日常监管工作中的应用。
各设区市市场监督管理局督促相关医疗器械经营企业落实唯一标识在经营环节的系统建设工作,鼓励其他医疗器械经营企业尽快参与实施唯一标识系统的运用。
(五)卫生健康管理部门
省卫生健康委员会同省药品监督管理局、省医疗保障局组织使用单位参与试点工作,同时做好与国家卫生健康委员会的工作衔接;负责组织协调指导唯一标识在医疗机构临床工作中的应用,研究解决医疗器械唯一标识与医疗器械管理、临床应用等系统衔接中的问题,探索唯一标识在日常卫生健康管理中的应用模式和方法。
各级卫生健康行政部门会同各设区市、县级市场监督管理局督促指导辖区内的医疗机构加强本单位信息化系统建设,探索运用唯一标识实现对医疗器械的精细化管理。
(六)医疗保障部门
省医疗保障局根据医保标准化建设的要求,联同省药品监督管理局、省卫生健康委员会做好医保定点医疗机构医用耗材代码与医疗器械唯一标识的衔接工作,研究解决医疗器械唯一标识信息化系统数据等方面存在的问题,并积极向国家医疗保障局反馈;负责研究医疗器械唯一标识实施品种在阳光采购、医保结算领域的衔接应用工作,根据需要协调医疗器械唯一标识系统与省药品(医用耗材)阳光平台进行对接。
五、工作措施
(一)对《公告》确定的9大类69个高风险第三类医疗器械品种的管理措施
1.自2021年1月1日起,注册人应严格按照《医疗器械唯一标识系统规则》等有关要求开展产品赋码、数据上传和维护等工作,并对数据真实性、准确性、完整性负责。
2.自2021年1月1日起,申请首次注册、延续注册或者注册变更时,注册申请人应当在国家药品监督管理局医疗器械注册管理系统(eRPS系统)中提交其最小销售单元的产品标识。
3.2021年1月1日起生产的相关品种,在其上市销售前,注册人应当按照相关标准或者规范要求将最小销售单元、更高级别包装的产品标识和相关数据上传至国家药品监督管理局医疗器械唯一标识数据库。
(二)对实施唯一标识品种的优先措施
1.对实施医疗器械唯一标识并完成向国家药品监督管理局唯一标识数据库上传数据等工作的注册人,在申报第二类医疗器械注册及生产许可、第三类医疗器械生产许可时,省药品监督管理局进行单独排序、优先办理。
2.对实施医疗器械唯一标识并完成向国家药品监督管理局唯一标识数据库上传数据等工作的注册人,相关品种在申请全省医用耗材阳光挂网时予以优先审核办理。
六、组织保障
(一)明确工作职责。各单位要高度重视唯一标识实施工作,明确职能部门,指定专人负责,及时报告医疗器械唯一标识实施过程中的问题和建议。
(二)建立协调机制。为保障唯一标识工作有序开展,省药品监督管理局、省卫生健康委员会、省医疗保障局建立医疗器械唯一标识实施工作长效沟通协调机制,共同研究唯一标识在医药、医疗、医保等领域衔接应用中的问题,及时分析、总结实施工作经验,逐步推进医疗器械唯一标识系统的全面实施,形成共同参与、共创价值、共享成果的数据共享机制。
(三)加强政策引导。医疗器械唯一标识系统建设是一项复杂的基础性、系统性工作,各部门、各单位要通过多种渠道、多种方式加强政策宣贯和政策引导,提升注册、生产、经营和使用等单位对唯一标识实施工作的认知度。
七、联系方式
省药品监督管理局行政审批处:常林凤,电话:025-83273709;省卫生健康委员会医政医管处:丁远峰,电话:025-83620810;省医疗保障局医药价格和招采采购处:高小敏,电话:025-83290269;省医疗保障局医药服务管理处:王韦玮,电话:025-83290244。
八、其他本方案自发布之日起实施,如果国家相关部门对实施医疗器械唯一标识工作有新的要求,按有关规定执行。
附件:1.附件1:第一批实施医疗器械唯一标识的产品目录.docx
2.附件2:第一批国家高值医用耗材重点治理清单.docx
3.附件3:医疗器械生产企业实施唯一标识流程图示例.docx
4.附件4:国家药品监督管理局唯一标识系统数据填报示例.docx
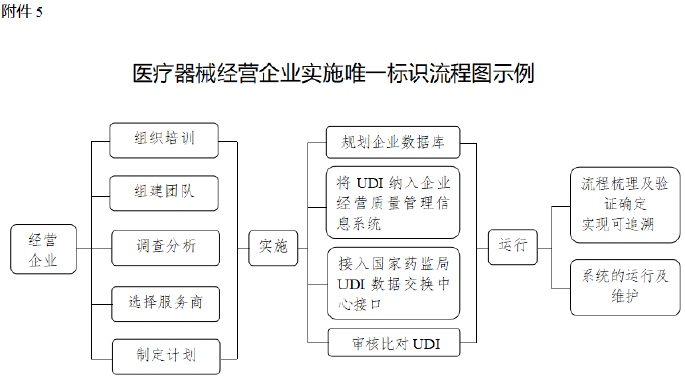
5.附件5:医疗器械经营企业实施唯一标识流程图示例.docx
6.附件6:医疗机构实施唯一标识流程图示例.docx
附件1:


附件3: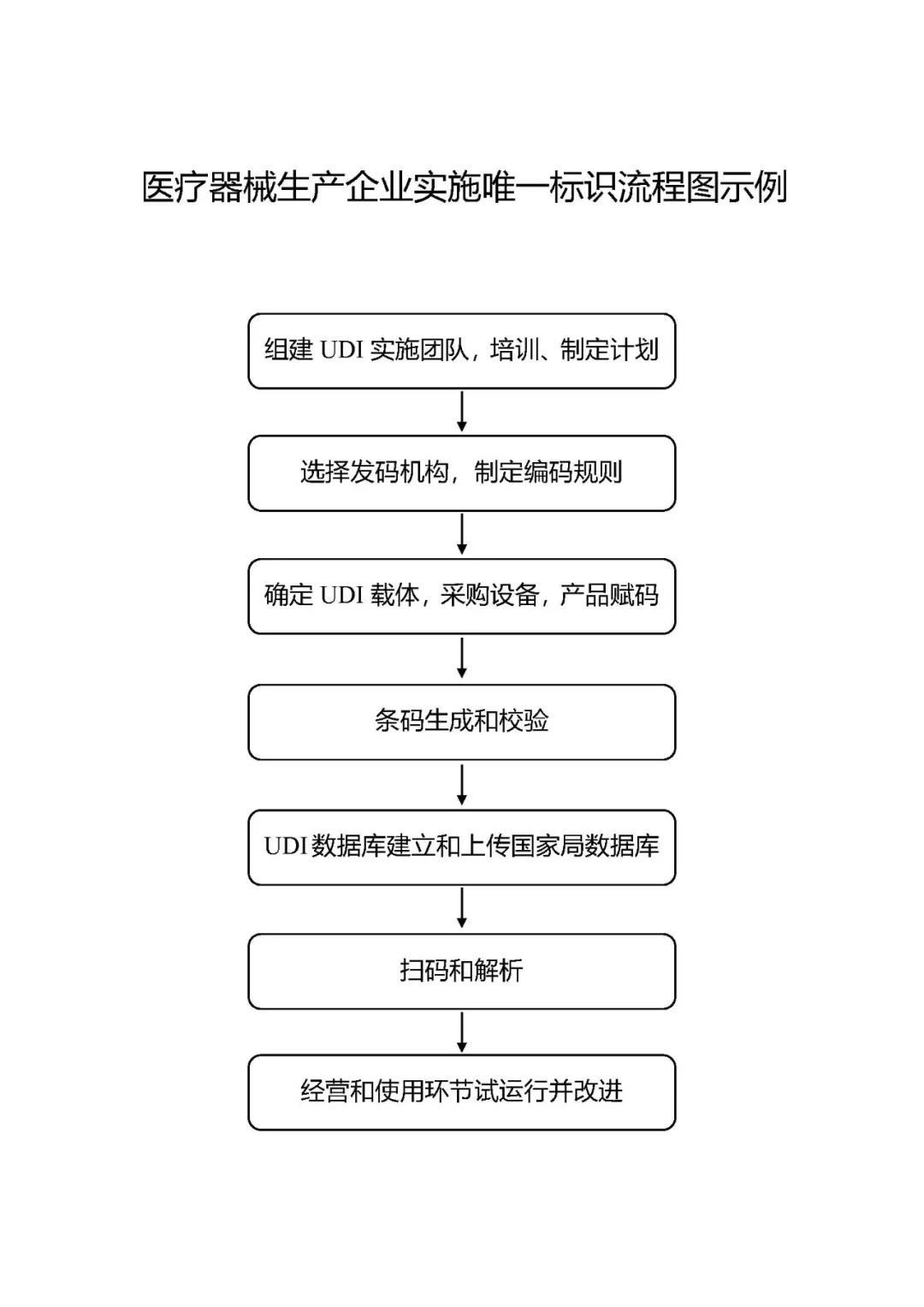
附件4:
国家药品监督管理局唯一标识系统
数据填报示例
一、国家药监局UDI管理信息系统注册与登录
先到国家药监局网站办事大厅(http://zwfw.nmpa.gov.cn/web/index)注册账号,注册后登录,在法人空间中绑定“医疗器械唯一标识管理信息系统”,并直接授权创建新账号,用创建好的账号登录“医疗器械唯一标识管理信息系统”。
二、国家药监局UDI管理信息系统数据填报
国家药监局UDI管理信息系统数据维护可以采用系统提供的网页填报或通过国家药监局UDI系统提供的接口,自建管理系统或第三方系统填报,第三方系统比较适合产品数量多的企业。
如果采用网页维护产品标识信息,具体数据申报操作可查看国家药监局网站-医疗器械-医疗器械唯一标识集成服务(https://udi.nmpa.gov.cn/)。
1.维护注册证/备案证信息;
2.维护产品标识信息,并提交等待发布;
3.填报时的操作事项:
数据保存状态分三种,草稿、未发布和已发布。草稿是指填报过程中随时可以进行保存,防止数据丢失,内容也随时可以修改。未发布是指信息填写完成并确认无误后,填写好发布日期,正式提交给国家UDI管理信息系统。已发布是指国家UDI管理信息系统根据企业提交的发布日期,自动对外公开发布,对已发布的信息如果修改,需要通过变更申请修改
本文著作权属原创者所有,不代表本站立场。我们转载此文出于传播更多资讯之目的,如涉著作权事宜请联系删除。