来源: 械企必读2022年11月09日 15:42
医疗器械飞行检查是医疗器械监管部门围绕安全风险防控开展的不预先告知的监督检查,具有突击性、独立性、高效性等特点。国家药品监督管理局医疗器械监督管理司按照《药品医疗器械飞行检查办法》要求, 坚持以问题为导向,以风险管控为核心,以“双随机、一公开”为基本原则,即随机抽取企业和检查员,公开检查结果。
持续对医疗器械生产企业实施飞行检查,对检查发现问题及处理措施进行公告。不仅对企业形成强大威慑力、强化了企业自觉实施质量管理体系的意识,而且也提升了检查员善于发现问题、依法依规处理问题的能力。
01、飞检的职责分工
按照职责分工,国家药品监督管理局医疗器械监督管理司根据监管重点制定年度医疗器械生产企业飞行检查计划,国家药品监督管理局食品药品审核查验中心负责检查任务实施。
(一)投诉举报或者其他来源的线索表明可能存在质量安全风险的;
(二)检验发现存在质量安全风险的;
(三)药品不良反应或者医疗器械不良事件监测提示可能存在质量安全风险的;
(四)对申报资料真实性有疑问的;
(五)涉嫌严重违反质量管理规范要求的;
(六)企业有严重不守信记录的;
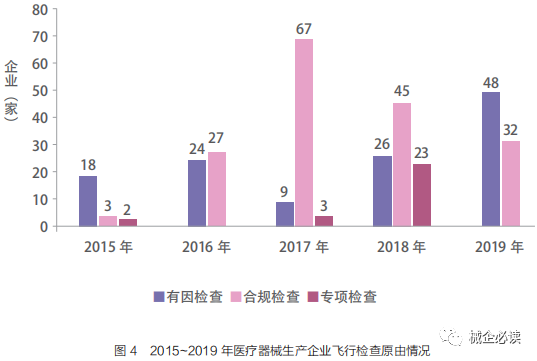
随着监管需要的不断提升,现阶段飞行检查主要包括合规检查,因投诉举报、检验、不良反应监测等风险信号启动的有因检查,以及某类产品的专项检查。2015~2019 年共开展有因检查125 家,占比 38.2% ;合规检查174 家,占比 53.2% ;专项检查28 家,占比 8.6% 。(如下图所示)
03、飞检品种
随着飞行检查的企业数量逐年增加,检查的品种范围也不断扩大。2015 年飞行检查仅涉及无菌类和植入类产品,且这两类高风险产品持续保持较高的检查比例,占全年检查总数量的 60%以上。2016 年起,飞行检查覆盖有源、体外诊断试剂类产品。2016 年 12 月 21 日,《医疗器械生产质量管理规范附录定制式义齿》发布,为实地调查企业实施情况,2018 年启动了定制式义齿产品的飞行检查。2015~2019 年 飞 行 检 查 的企业中,无菌医疗器械生产企业151 家,植入医疗器械生产企业62 家,有源医疗器械生产企业47 家,体外诊断试剂医疗器械生产企业 31 家,定制式义齿 11 家,其他 25 家(如下图所示)。

04、检查结果
医疗器械生产企业飞行检查评定原则规定,现场检查发现企业存在严重缺陷的,或不符合项可能对产品质量产生直接影响的,企业必须停产整改;如仅存在一般项目不符合要求,且不对产品质量产生直接影响的,企业必须限期整改。
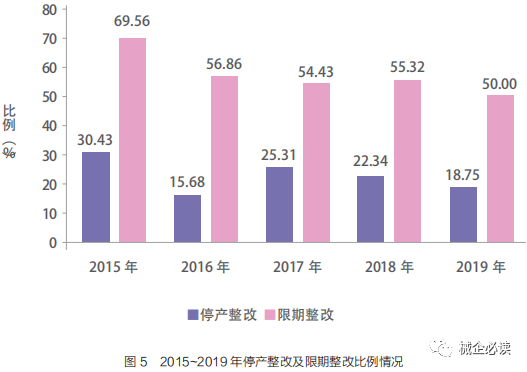
国家药品监督管理局网站定期公开飞行检查结果及其缺陷情况,对于责令停产整改的企业予以通告,限期整改的企业予以公告。检查结果公开一方面震慑被检查的企业,提升企业对质量体系的敬畏和执行规范的自觉性 ;另一方面,其他企业也可以间接学习研究缺陷问题自查自纠。
此外,实施飞检的部门及有关工作人员如有违规行为也将受到处罚。
有下列情形之一的,应当公开通报;对有关工作人员按照干部管理权限给予行政处分和纪律处分,或者提出处理建议;涉嫌犯罪的,依法移交司法机关处理:
(一)泄露飞行检查信息的;
(二)泄露举报人信息或者被检查单位商业秘密的;
(三)出具虚假检查报告或者检验报告的;
(四)干扰、拖延检查或者拒绝立案查处的;
(五)违反廉政纪律的;
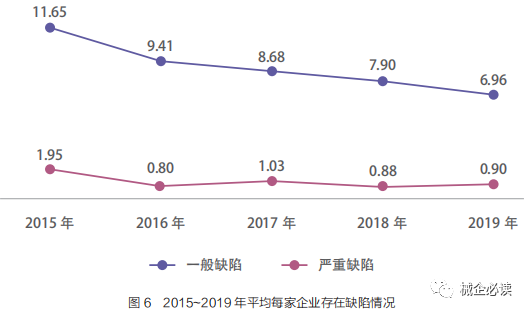
2015~2019 年,医疗器械生产企业飞行检查,现场发现缺陷3056 项,其中严重缺陷 323 项,一般缺陷 2733 项。平均每家企业发现一般缺陷数量逐年降低,严重缺陷数量基本持平。
医疗器械监管部门需要深入研究落实“放管服”改革,在继续加大飞行检查力度的同时,指导企业走出质量体系的误区,提升企业的认知水平,使质量体系真正落实到位,确保医疗器械产品的质量安全。
参考资料:
1.《药品医疗器械飞行检查办法》(2015 年 6 月 29 日国家食品药品监督管理总局令第 14 号公布 自2015 年 9 月 1 日起施行)
2.魏澜,聂涛,王爱君.2015~2019年医疗器械生产企业飞行检查情况综述[J].中国食品药品监管,2021(02):54-62.
本文著作权属原创者所有,不代表本站立场。我们转载此文出于传播更多资讯之目的,如涉著作权事宜请联系删除。



