医疗器械注册在医疗器械注册管理办法中的定义是国家药品监督管理部门根据医疗器械注册申请人的申请,依照法定程序,对拟上市的医疗器械的安全性、有效性研究及其结果进行系统评价,以决定是否同意其申请的过程。
定义中有几个点简要说明一下,第一个就是依照法定程序,注册的流程需要满足相关的规定,第二就是需要评价上述产品的安全性和有效性,那安全性和有效性是我们准备注册资料一个前提和出发点,如何获取能够体现产品安全性和有效性的资料就是我们在前期需要考虑好的。医疗器械设计开发和注册的关系见下图:
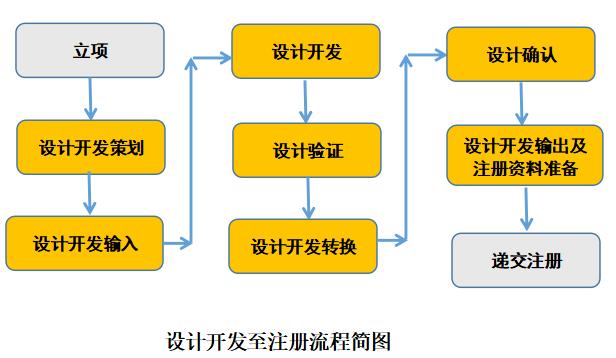
在图中大家可以看到,医疗器械注册资料的准备在设计开发输出之前完成的或是在同步进行准备,就是在参考医疗器械质量管理规范现场检查指导原则的时候,将注册资料做为了开发输出的部分,我们的注册资料是在设计开发过程中输出来的内容。
又因为注册是设计开发的一部分,那么我们什么时候开始进行注册资料的准备或者是什么节点开始有注册相关的人员介入到我们的设计开发过程中去呢?实际上从设计立项至设计开发的输出以及各个阶段的评审中,我们都是要有注册专业人员或团队介入和参与的,参与注册相人员是要贯穿到产品的整个生命周期。当然在我们的产品上市以后也会有相关的人员需要关注产品的一些变化甚到递效一些产品变更注册的一些资料。为了能够更好的配合研发注册工作,我们会需要有具有相关条件的人员去参与,可以是一个人也个以是一个团队去配合产品的注册工作。
在产品注册资料编写前除了我们获取必要的技术资料去用于编写文件,我们还有其它几部分的工作要做,例如我们的产品分类,这是在产品定型后确定产品类别的,我们相关人员要根据我们的预期用途和产品的结构组成去判定我们的产品是属于那一类的,我国医疗器械根据风险级别分为一二三类。也分别由不同的审批机构来审核,确实了类别也就了审批机构,是由地方局还是国家局,当然也可以是判定是否是一个免临床的产品,还有就是可以根据产品的情况确定我们的申报方式,除了分类以外,我们还要关注同类产品的上市情况。如果是创新的医疗器械还可以进行创新申请,在做创新申请的时候还需考虑相关的专利方面问题,了解相关产品专利的情况,避免专利侵权。进行专利查询,确定产品上市路径、同产品的上市情况、项目预算的确定。
注册前的准备工作,在前面研发的过程中,设计开发、立项、输出、验证确认、评审等阶段都会有注册相关的事项,在研发立项价段我们可以进行适用的标准、法规、注册指导原则的搜集,基于我们产品现在的拟开发情况搜集一些大部分产品通用的标准和法规,比如说医疗器械监督管理条例,总局发布的医疗器械分类目录公告,医疗器械临床试验设计指导原则,还会的一些产品的YY/T专业标准、还有一些我们注册人员都比较关注的注册指导原则。
产品研发阶段所要做的注册相关的工作。注册是从设计开发资料中获取的满足产品安全性有效性信息。在注册检验阶段,按照我们的标准要求,在设计开发验证阶段我们需要制定一个验证计划。基于我们的验证计划我们实施我们的验证活动,注册检验就是我们的设计开发验证的一部分但也不能说产品的研发结束了然后就可以注册检验了,这个想法是不正确的。其实注册检验就是我们设计开发验证阶段的一个工作,一般的验证会分为内部验证和外部验证,内部验证可以通过测试评审等方式,外部我们可能要找一些第三方机构,比如国家授权要求检验单位,例如生物相容性相关的实验室。生物相容性虽然是做为了一个研究性的项目,但是一般企业也是没有条件去独立完成的,还是会需要第三方机构参与完成。还有我们的一些有源产品中电磁安全、电磁兼容等这些试验活动在企业内可能也是很难独立完成的。
注册检验的流程第一步是技术要求的编写。在编写技术要求的时候需要考虑两关键部分,一个就是注册单元的划分,比如说我们产品现在有5个型号,假如我们划分为三个注册单元,不同的注册单元会编写不同的技术要求,另外还是要考虑设计输入的要求,因为标准法规里要求设计输入时要考虑跟产品预期用途相关的那些产品结构性能相关的要求,而这些要求是和技术要求是有关联性的。
完成了设计输入和技术要求的编写后就进入了样品和样机的准备,样品和样机的设计开发转换过程中输出的体现。你的样品样机要具备代表性,在这个阶段的产品可以做为我们注册检验的样机。其它的技术资料,这里可以通过电话咨询、官网等去查询一下在注册检验前需要准备的一些资料,比如关键元器件的清单、一些真实性符合的声明,等接下来就可以实施注册检验活动了。
关于检验机构的选择。在这里简单说两个方面,选择的原则就是注册检验应该在具有医疗器械检验资质且检验项目在其承检范围内的检验机构进行,承检范围是满足,并肯具有资质,选择途径我们可以通过,器审官网查询,进行网站查询,也可以通过直接咨询医疗器械检验中心,当然还有一些产品可能是没有列入承检范围的医疗器械,对于这类产品,我们要进行申请,由相应的注册审批的部门指定有能力检验的机构进行检验,或者申请人(生产企业)向国家局器械注册司提交由有检验能力的检验机构进行检验的申请,得到批复后可以进行相关的检测活动。
注册检验的流程,首先我们准备了一些需要注册检验的资料,比如相关的样品样机,因此,对于医疗器械注册检验的产品,尤其是首次注检的产品,由于不是通过随机抽样而获取,样品的数量有时候不是抽取的,可能是样机或样品,还有相关的检验协议,接着我们会和检验机构去签署检验合同。提交我们的技术资料和样品,不同的检验机构,委托检验流程会有一些差异,有的检验机构可能允许我们把样品先邮寄过去再签合同,有的机构可能会要求先签合同再提供样品或同步送样,签了合同提供了样品样机以后,检验机构会分配检验人员与我们生产企业的负责人员进行沟通,对于一些技术细节展一沟通,然后开始检测,最后出具检测报告,当出具检测报告以后会有设计开发的验证工作,评审设计输出满是否足输入的要求,输入的性能指标、一些安全性的要求在这个时候就要评估现在的内部和外部的验证是不是能满足输入的要求。注册检验是产品上市前评价的第一个主要环节,对于注册审查及上市后监管都起着重要的作用。
